17 січня 2025 року в Інституті біохімії ім. О.В. Палладіна НАН України відбудеться чергове засідання міждисциплінарного загальноакадемічного семінару у галузі природничих наук «Актуальні питання фізико-хімічної та математичної біології».
Доповідь «СоАлювання як нова складова системи антиоксидантного захисту клітини і новий механізм регулювання активності протеїнів» виголосить завідувач відділу сигнальних систем клітини Інституту молекулярної біології і генетики НАН України академік НАН України Валерій Філоненко.

Академік НАН України Валерій Філоненко (фото пресслужби НАН України)
Початок заходу – о 10:30 (орієнтовна тривалість – 2 години).
Адреса: Київ, вул. Леонтовича, 9, актова зала Інституту біохімії ім. О.В. Палладіна НАН України.
Посилання для дистанційного долучення до семінару: https://meet.google.com/bsj-ruey-ece
УВАГА! У разі повітряної тривоги працює укриття в будівлі Президії НАН України (вул. Володимирська, 54).
Про тему доповіді
Коензим А (СоА) є життєво необхідним для всіх клітин кофактором, що відіграє ключову роль у клітинному метаболізмі, біосинтезі основних клітинних компонентів, регулюванні експресії генів тощо. Нещодавно науковці Інституту молекулярної біології і генетики НАН України разом зі співавторами з’ясували, що СoA може також виконувати функцію антиоксиданта – як у прокаріотичних, так і в евкаріотичних клітинах за умов окислювального стресу, впливаючи при цьому і на активність протеїнів. Ця нетрадиційна функція СoA опосередкована утворенням за його участі нової посттрансляційної модифікації цистеїнових залишків протеїнів, що отримала назву СоАлювання (CoAlation). Доповідач висвітлить історію цього відкриття, поточні знання та майбутні напрями дослідження.
Молекулярне клонування та характеристика СоА-синтази. На початку 2000-х років методом двогібридної системи дріжджів науковці Інституту молекулярної біології і генетики НАН України разом спільно з іноземними колегами виявили та клонували кДНК нового зв’язувального партнеру кінази рибосомного протеїну S6 (S6K1) яким виявився невідомий на той час протеїн. Надалі було з’ясовано, що він містить два функціональні домени, які мають фосфопантотеїн-аденілілтрансферазну і дефосфо-СoA-кіназну активності. Отже, автори дослідження ідентифікували біфункціональний ензим, що відповідає за останні два з п’яти етапів біосинтезу СoA в клітині – СоА-синтазу – та клонували його ген.
Під час подальших досліджень було виявлено низку регуляторних зв’язків СоА-синтази, зокрема з кількома сигнальними протеїнами, серед яких S6K1, фосфатидилінозитол-3-кіназа (PI3K), кінази родини Src, Shp2 тирозинфосфатаза, а також із протеїном EDC4, що входить до складу Р-тілець (Processing Bodies). Завдяки цим дослідженням вдалося з’ясувати, що на додачу до пантотенаткінази (PanK), яка була відома як головний регулятор біосинтезу СoA, СоА-синтаза також функціонує як ензим, що регулює швидкість біосинтезу СoA.
Згодом було встановлено, що утворення СоА-біосинтетичного комплексу активується за умов окислювального стресу, тоді як інсулін і фактори росту гальмують цей процес. Отже, науковці показали кластеризацію ензимів біосинтезу СoA навколо СоА-синтази, що, своєю чергою, асоціюється із зовнішною мембраною мітохондрій і може сприяти ефективному каталізу біосинтезу СoA шляхом каналізації субстратів і проміжних продуктів за умов стресу.
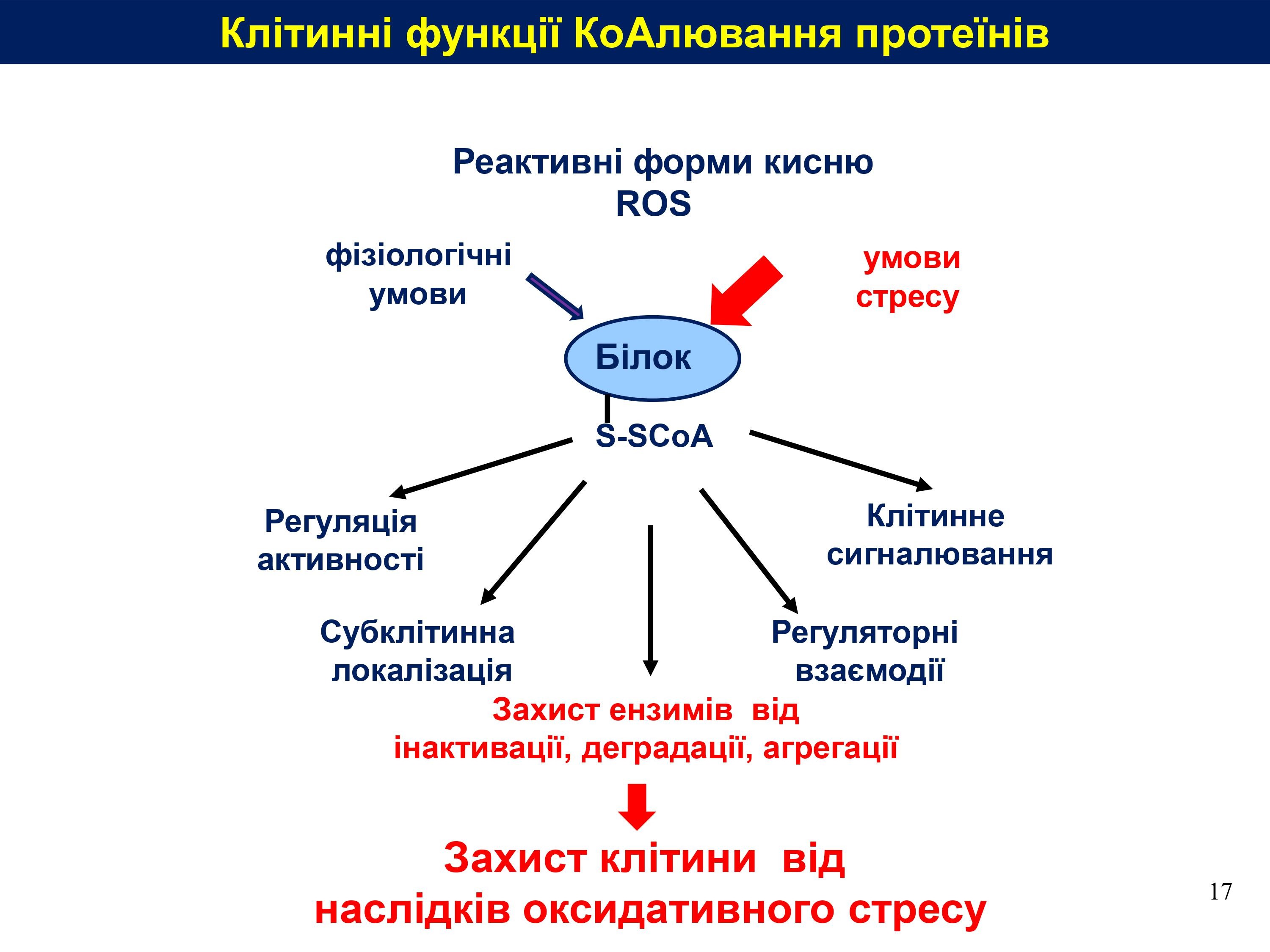
Відкриття СoAлювання протеїнів та антиоксидантної функції СoA. З моменту відкриття СoA дослідження зосереджувалися переважно на його ролі в катаболічних і анаболічних процесах у клітині. Функцію ж СoA як низькомолекулярного тіолу в антиоксидантному захисті, на зразок глутатіону, не було досліджено. Наявність тіолової групи в хімічній структурі СoA й індукування біосинтезу СoA окисниками спонукали авторів дослідити, чи бере СoA участь також у регулюванні окисно-відновного стану клітини. Для цього було створено анти-СoA моноклональні антитіла і з їхньою допомогою з’ясовано, що СoA використовує свою тіолову групу для утворення дисульфідного зв’язку із залишками цистеїнів протеїнів у клітинах ссавців за умов окислювального стресу. Цей тип нової посттрансляційної модифікації протеїнів отримав назву СоАлювання. Надалі індукцію СоАлювання було виявлено і за умов метаболічного стресу.
Встановлено, що СоАлювання є дуже поширеною модифікацією, яка відбувається у клітинах як ссавців, так і інших організмів, зокрема в бактеріях, дріжджах, амебах і мухах, що зазнають окислювального або метаболічному стресу.
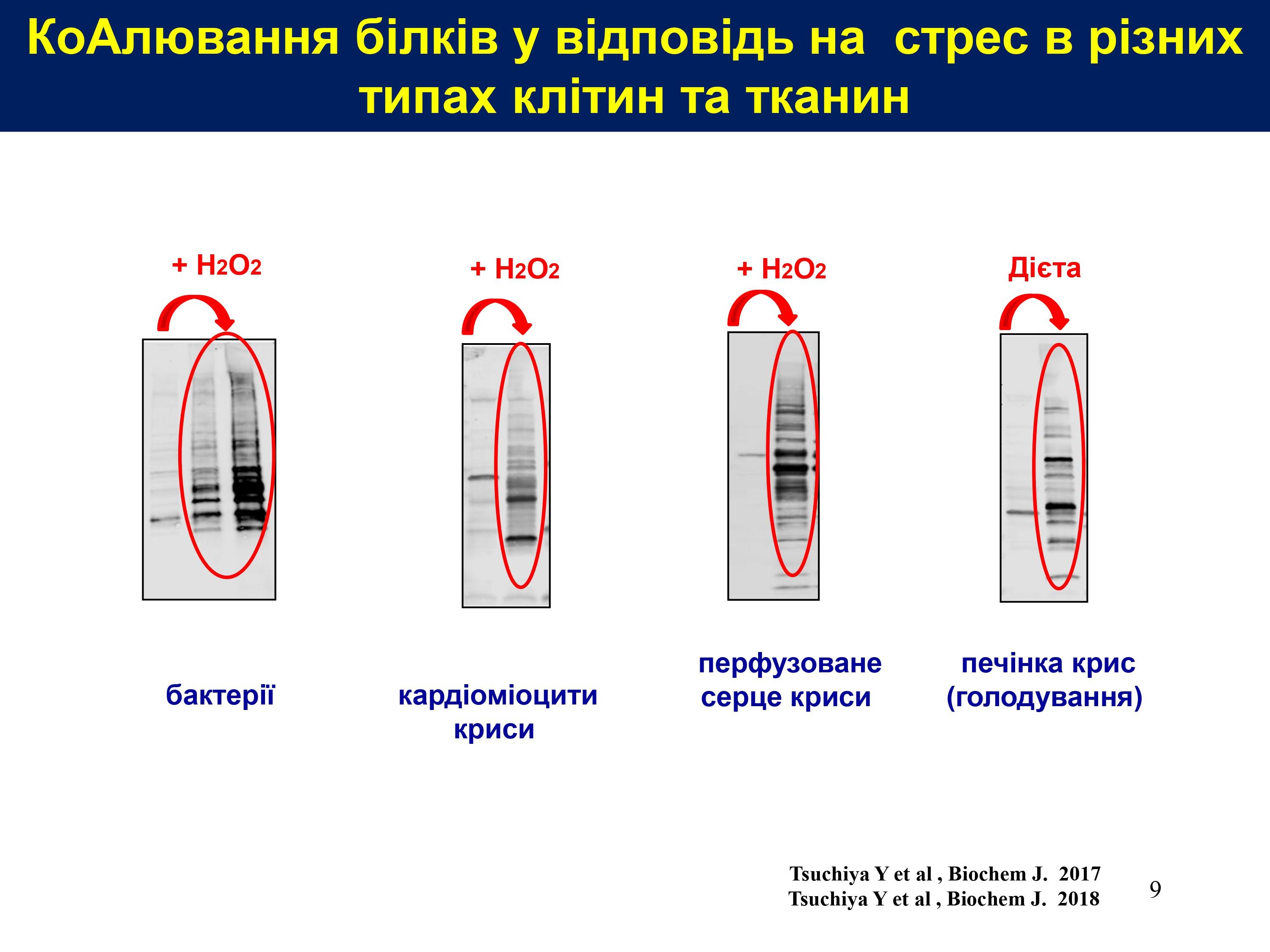
Методом мас-спектрометричного аналізу в бактеріях і клітинах/тканинах ссавців уже ідентифіковано майже 2100 протеїнів які зазнають СоАлювання за умов окислювального або метаболічного стресів. За допомогою біоінформатичного аналізу з’ясовано, що вони переважно беруть участь у метаболічних і біосинтетичних процесах та у відповіді клітини на стрес.
Функціональне значення СоАлювання. Науковці Інституту молекулярної біології і генетики НАН України та їхні співавтори продемонстрували пригнічення ензиматичної активності низки метаболічних і сигнальних протеїнів, які за умов окислювального стресу зазнають СоАлювання за залишками цистеїнів, розташованих у каталітичній кишені, in vitro. Серед них – аконітаза, креатинкіназа, піруватдегідрогеназа кіназа 2, гліцеральдегід-3-фосфатдегідрогеназа (GAPDH) і гідроксиметилглутарил-СоА-синтаза, Аврора-кіназа А, протеїн-супресор метастазування NME1, кіназа рибосомного протеїну S6 – S6K1). Для транскрипційного фактора AgrA показано, що його СоАлювання in vitro в ДНК-зв’язувальному домені має інгібувальний вплив на зв’язування з ДНК.
Відомо, що тривалий оксидативний стрес може призводити до надмірного окиснення залишків цистеїнів до сульфокислот і, як наслідок, інактивації та подальшої деградації протеїнів. На прикладі GAPDH встановлено, що in vitro СоАлювання захищає ензим від інактивації пероксидом водню, тим самим вказуючи на антиоксидантні властивості СоА.
Для Aurora A кінази було виявлено унікальний спосіб її зв’язування з СоА за присутності окиснювача, що пояснював інгібіторний вплив СоА на її активність. З’ясовано, що цей процес відбувається через специфічну взаємодію фрагмента АDP із АТP-зв’язувальною кишенею активного центру кінази, що водночас стабілізується СоАлюванням Cys290 активаційної петлі кінази.
Відомо, що порушення редокс-балансу в клітині супроводжує низку важких патологій людини, зокрема нейродегенеративні захворювання. За даними авторів досліджень, імунореактивність анти-CoA антитіл значно підвищується у зразках мозку за хвороби Альцгеймера та Паркінсона. Для протеїну ж Tau, що входить до складу нейрофібрилярних клубків, показано, що in vitro СоАлювання впливає на його здатність до димеризації і, можливо, до агрегації вже у клітині.
Механізм СоАлювання/деСоАлювання. За аналогією з S-глутатіонілюванням протеїнів, що досліджується протягом останніх трьох десятиліть, автори вважають, що мають існувати й ензими, відповідальні за регулювання циклу СоАлювання/деСоАлювання, а саме: СoA-трансфераза(и); СоА-редоксин(и); СоА-залежна(і) пероксидаза(и) і СoA дисульфідредуктаза(и). На сьогодні у клітинах бактерій науковці Інституту зі співавторами вже ідентифікували два ензими, що каталізують реакцію деСоАлювання, а саме – тіоредоксин подібний протеїн YtpP і тіоредоксин А (TrxA).
Висновки та перспективи на майбутнє. Отже, ідентифіковано новий тип пострансляційної модифікації протеїнів – СоАлювання. Його функція полягає щонайменше у захисті протеїнів від окиснення за умов оксидативного стресу та в регулюванні їхньої активності.
Розуміння молекулярних механізмів циклу СоАлювання/деСоАлювання у прокаріотичних і евкаріотичних клітинах є одним із головних напрямів майбутніх досліджень. Крім того, важливо з’ясувати, які протеїни можуть бути субстратами СоАлювання та які фактори визначають їхню селективність.
Можливе терапевтичне застосування знань про СоАлювання потребує подальших досліджень. Наприклад, фармакологічне модулювання рівнів СоАлювання може стати новим підходом до лікування захворювань, пов’язаних з оксидативним стресом, таких як нейродегенеративні хвороби або рак.

Довідково
Міждисциплінарний загальноакадемічний семінар у галузі природничих наук «Актуальні питання фізико-хімічної та математичної біології» започатковано на базі Інституту біохімії ім. О.В. Палладіна НАН України відповідно до Постанови Президії НАН України № 134 від 22 березня 2023 р.
Мета семінару – періодичне заслуховування й обговорення наукових доповідей, присвячених застосуванню сучасних експериментальних і теоретичних методів хімії, фізики й математики для розв’язання нагальних проблем сучасної біології, зокрема у галузі біохімії, біофізики, молекулярної та клітинної біології, біоенергетики, геноміки, медичної біології, фармакології, нанобіотехнології, системної та синтетичної біології.
Семінар унеобхіднений прогресом таких «перехресних» наук і наукових напрямів, як біофізична хімія, фізична біохімія, хімічна біофізика, біохімічна фізика, фізико-хімічна біологія, фізика живого, математична біофізика, теоретична біологія, біоінформатика, штучний інтелект в біології та медицині тощо.
Засідання семінару щомісяця відбуваються в Актовій залі Інституту біохімії ім. О.В. Палладіна НАН України (Київ, вул. Леонтовича, 9). Долучитися до семінару можна також в онлайн-режимі. «Двері» семінару відкриті не лише для науковців Національної академії наук України та працівників і студентів українських закладів вищої освіти, а й для всіх охочих.
Наступне засідання семінару заплановано на лютий 2025 року.
Пропозиції щодо виступів із доповідями (обсяг тез доповіді – 1–2 сторінки) надсилайте, будь ласка, на електронні скриньки керівника семінару – заступника директора з наукової роботи Інституту біохімії ім. О.В. Палладіна НАН України, завідувача відділу біохімії м’язів цього Інституту академіка Сергія Олексійовича Костеріна: kinet@biochem.kiev.ua; kosterin.serg@gmail.com.
За анонсами засідань семінару стежте також на сайті Інституту біохімії ім. О.В. Палладіна НАН України.
Відеозаписи попередніх засідань доступні на YouTube-каналі Інституту.
За інформацією Інституту біохімії ім. О.В. Палладіна НАН України


